Prevalência de mutação ESR1 e alterações na paisagem genômica em câncer de mama HR+/HER2− tratado com CDK4/6i
- Gerar link
- X
- Outros aplicativos
MENSAGEM PARA LEVAR PARA CASA
- Este estudo analisou perfis genômicos tumorais de 5.910 pacientes com câncer de mama metastático HR+/HER2− do banco de dados Flatiron de acordo com o tratamento e o status de resistência à terapia endócrina (ETR). As mutações no ESR1 foram mais prevalentes em pacientes com ETR secundário (recidiva após> 2 anos de TE adjuvante) do que naqueles com ETR primário (recidiva após <2 anos de TE adjuvante), enquanto as mutações TP53 foram mais comuns em pacientes com ETR primário. Esses perfis genômicos mudaram quando a recidiva ocorreu aproximadamente 1 ano de TE adjuvante. Os pacientes tratados com inibidor de CDK4/6 mais inibidor de aromatase (IA) no cenário metastático de primeira linha desenvolveram significativamente mais mutações ESR1 do que aqueles tratados apenas com IA, especialmente com >1 ano de tratamento. Os pacientes tratados com terapia ou quimioterapia à base de fulvestrant não apresentaram aumento significativo nas mutações ESR1.
- Estes dados apoiam uma definição biológica de ETR primária que inclui pacientes com recaída após ≤1 ano em TE adjuvante e sugerem que uma duração de 1 ano com inibidor de CDK4/6 mais IA representa um ponto de corte onde emergem taxas mais elevadas de mutações em ESR1.
O surgimento de resistência aos inibidores de CDK4/6 em pacientes com câncer de mama metastático ressalta a necessidade de explorar estratégias terapêuticas alternativas. Apesar da eficácia inicial das opções de tratamento existentes, os tumores invariavelmente desenvolvem mecanismos de resistência, resultando na progressão da doença. Consequentemente, existe uma necessidade premente de intervenções terapêuticas inovadoras para enfrentar este desafio clínico. Os esforços de investigação centram-se na elucidação dos mecanismos subjacentes à resistência e no desenvolvimento de novas terapias combinadas para superar a resistência e prolongar a sobrevivência livre de progressão. Compreender como a exposição aos inibidores de CDK4/6 impacta o cenário genômico do tumor é importante para ajudar a esclarecer possíveis opções futuras de tratamento direcionado. Esta informação também ajudará a orientar futuras investigações, que, esperançosamente, identificarão novas estratégias terapêuticas.
Os investigadores do presente estudo aproveitaram dados do mundo real usando um grande banco de dados de perfis genômicos de tumores de quase 6.000 pacientes com câncer de mama metastático HR+/HER2−. As observações observadas neste importante estudo serão úteis para otimizar futuras abordagens de tratamento
Introdução
Os primeiros grandes conjuntos de dados genómicos de amostras de tumores disponíveis publicamente produziram inúmeras descobertas e continuam a ser conjuntos de dados de referência para a investigação do cancro 1 , 2 , 3 . Desde então, outros estudos caracterizaram o panorama genômico dos cânceres de mama metastáticos (mBC) 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , e conjuntos de dados que compreendem a história clínica do paciente e dados genômicos do tumor estão se tornando cada vez mais amplamente disponível. Vários esforços estão em andamento para coletar, selecionar e publicar esses conjuntos de dados clínico-genômicos, incluindo o projeto AACR GENIE 14 , o estudo MSK-IMPACT 15 , o plasmaMATCH 16 ou o POG570 17 . Estudos com dados clínico-genómicos levaram à identificação de mecanismos de resistência, em particular mutações ESR1 , que estão associadas à progressão da doença em inibidores da aromatase (AI) em cancros da mama (BC) positivos para recetores hormonais HER2-negativos (HR+/HER2-). 15 , 16 , 17 , 18 , 19 , 20 , 21 , 22 . O amplo uso de inibidores de CDK4/6 (CDK4/6i) para tratamento de HR+/HER2-BC 23 , 24 levantou a questão da identificação de alterações associadas à resistência de novo e adquirida a CDK4/6i 25 , 26 , 27 , 28 e de forma mais geral de como a paisagem genômica de tumores virgens de CDK4/6i difere daqueles expostos a CDK4/6i 29 , 30 , 31 . Compreender estas diferenças é fundamental não só para adaptar estratégias de tratamento após a exposição a CDK4/6i 32 , mas também para conceber e interpretar ensaios clínicos para novas terapias direcionadas cujo benefício clínico, em comparação com os padrões atuais de tratamento, pode ser maior para tumores que abrigam mutações específicas, como ESR1 para antagonistas e degradadores seletivos de receptores de estrogênio orais (SERD) 33 , 34 ou PIK3CA e AKT1 para inibidores da via PI3K/AKT 35 .
Para caracterizar sistematicamente como os perfis genômicos dos tumores HR+/HER2- evoluem através das linhas de terapias, selecionamos uma coorte de 5.910 pacientes com mBC aproveitando um conjunto de dados do mundo real (RWD) de um banco de dados clínico-genômico desidentificado em todo o país que vinculou registros eletrônicos de saúde (EHRs) e perfil genômico abrangente (CGP). Dados semelhantes foram usados para recuperar associações conhecidas de pacientes e características tumorais com desfechos clínicos em câncer de pulmão 36 e outras doenças 37 , bem como comparar pacientes de ensaios clínicos com aqueles na prática comunitária 38 . Embora a RWD possa ser mais representativa da população global de pacientes 39 , a sua utilização para análises exploratórias requer considerações específicas. Aqui, nosso objetivo foi avaliar diferenças na prevalência de alterações genômicas entre amostras não pareadas em diferentes estágios do continuum de tratamento. Além de estudos anteriores 10 , 31 , realizamos análises estratificadas com base em potenciais confundidores do perfil genômico do tumor, como o local das amostras coletadas ou a história clínica do paciente, para excluir vieses e resultados espúrios devido a grupos desequilibrados. Depois de estudar o impacto da duração da terapia adjuvante na prevalência de alterações no TP53 , que é prognóstico 40 , e na ESR1 , que está associada à resistência à IA, avaliamos as mudanças no cenário genômico do tumor após o tratamento de primeira linha (1L) e em linhas posteriores (2L+). Encontramos diferenças significativas na prevalência de alterações em tumores expostos a AI+CDK4/6i em relação àqueles expostos apenas a AI. Os resultados baseados no RWD foram validados em dados de um ensaio clínico recente, o acelERA BC 41 . No geral, as diferenças que encontramos no cenário genômico do tumor sugerem que as estratégias de tratamento e o desenvolvimento de novas terapêuticas para HR+/HER2-BC avançado podem precisar ser adaptados para pacientes previamente tratados com CDK4/6i.
Resultados
Seleção de banco de dados e coorte
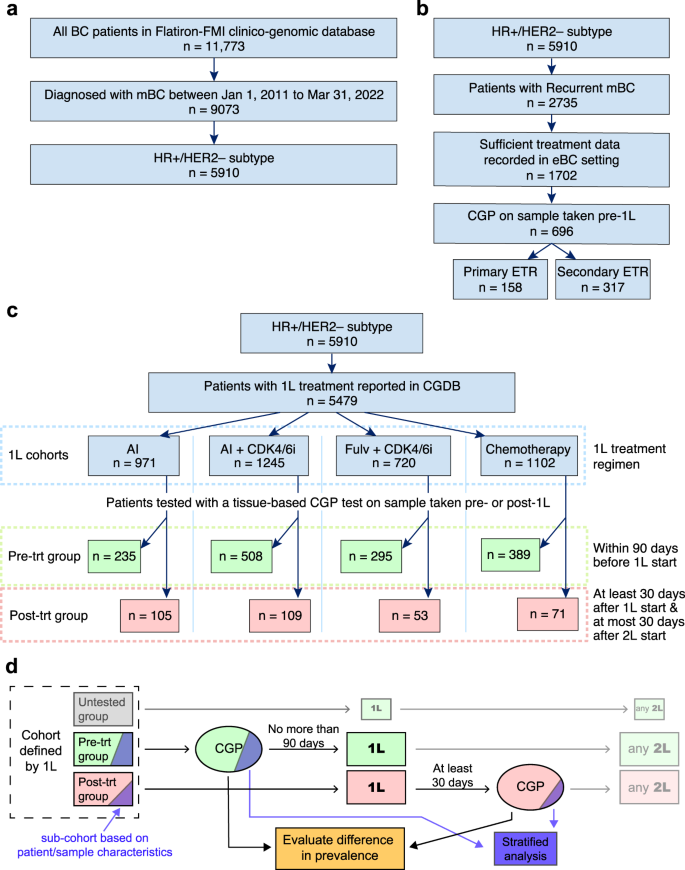
Este estudo baseou-se no banco de dados clínico-genômico (CGDB) desidentificado da Flatiron Health-Foundation Medicine Inc (FH-FMI), de âmbito nacional (com sede nos EUA). A CGDB foi descrita e validada em publicações anteriores 10 , 36 , 37 , 42 . Detalhes para inclusão de pacientes estão descritos na seção Métodos. Neste trabalho, focamos em uma coorte de 5.910 pacientes que foram diagnosticados com HR+/HER2-mBC (ver Figura 1a e Métodos) e tiveram diagnóstico metastático confirmado entre 1º de janeiro de 2011 e 31 de março de 2022 (data de corte do banco de dados).
a Seleção de pacientes com HR+/HER2-BC na CGDB. b Desgaste das coortes de eBC em nosso estudo. c Atrição das coortes de 1L em nosso estudo e divisão em grupos pré e pós-1L com base na linha de tratamento e no momento da coleta da amostra para teste de CGP. d Os pacientes são selecionados com base no seu regime de 1L e são divididos em subgrupos com base no momento do seu CGP. O efeito do tratamento nas alterações genéticas é estimado comparando a prevalência de alterações em tumores perfilados antes de 1L versus tumores perfilados após 1L. As análises estratificadas baseiam-se num estrato de pacientes definido por variáveis clínicas (por exemplo, doença de novo versus doença recorrente) ou características da amostra. eBC/mBC significa câncer de mama precoce/metastático, HR+/HER2- para receptor hormonal positivo HER2-negativo, CGP para perfil genômico abrangente, 1L para tratamento de primeira linha, ETR para resistência ao tratamento endócrino, CGDB para banco de dados clínico-genômico, AI para inibidor de aromatase, Fulv para fulvestrant.
Entre esses 5.910 pacientes, definimos múltiplas coortes com base na linha de tratamento. Primeiro, para estudar os efeitos da terapia adjuvante no cenário genômico do tumor, construímos uma coorte composta por 1.702 pacientes com CMm recorrente que tinham informações de tratamento suficientes registradas no banco de dados FH durante a doença do câncer de mama inicial (eBC) (Fig. 1b ) para avaliar seu status de resistência endócrina.
Classificamos os pacientes como resistentes endócrinos primários (<2 anos em TE adjuvante) ou secundários (>2 anos em TE adjuvante), guiados pela definição ESMO para resistência ao tratamento endócrino (ETR), com ambos os grupos recidivando dentro de 1 ano a partir do último TE. .
Em segundo lugar, definimos coortes de primeira linha com base no regime de tratamento avançado 1L: inibidores de aromatase (IA) sozinhos ou em combinação com inibidores de CDK4/6 (AI+CDK4/6i), fulvestrant com CDK4/6i (Fulv+CDK4/6i), ou quimioterapias (qualquer regime sem terapias endócrinas ou direcionadas). Outros regimes de tratamento de 1L, como fulvestrant sozinho, regimes baseados em SERM (moduladores específicos de receptores de estrogênio), CDK4/6i sozinho, regimes baseados em PI3Ki ou combinação de múltiplas terapias tiveram muito poucos pacientes com CGP (≤ 30 pacientes pós-1L) para permitir análises significativas. Em seguida, definimos nossos grupos pré e pós-tratamento para a coorte de 1L com base na data de coleta da amostra para o CGP. Para o grupo pré-1L, foram incluídos pacientes com amostra coletada no máximo 90 dias antes do início de 1L. Para o grupo pós-1L, incluímos pacientes cujas amostras foram coletadas pelo menos 30 dias após o início de 1L de terapia e no máximo 30 dias após o início de 2 L de terapia (Fig. 1c, d ). As características dos pacientes e da amostra para cada coorte são relatadas na Tabela 1 .
Por último, definimos coortes de pacientes de linha posterior, selecionando pacientes que tiveram exposição prévia à IA no cenário avançado (representando 78% das amostras coletadas após 2L) e dividindo-as com base na exposição prévia a CDK4/6i ou quimioterapias, independentemente da exposição a qualquer terapias endócrinas. Removemos pacientes que foram expostos a outras terapias direcionadas, como inibidores PI3K ou mTOR. Dividimos ainda essas coortes em dois grupos: amostras coletadas pelo menos 30 dias após o início da segunda linha e não mais que 30 dias após o início da quarta linha (2–3L) e aquelas coletadas pelo menos 30 dias após o início da quarta linha. a quarta linha (4L+). As propriedades demográficas e amostrais para cada coorte são relatadas na Tabela Suplementar 1 . Para os pacientes que forneceram múltiplas amostras, consideramos as amostras de forma independente com base no horário de coleta e tratamentos anteriores.
A duração da terapia adjuvante está associada a diferenças nos perfis genômicos do tumor
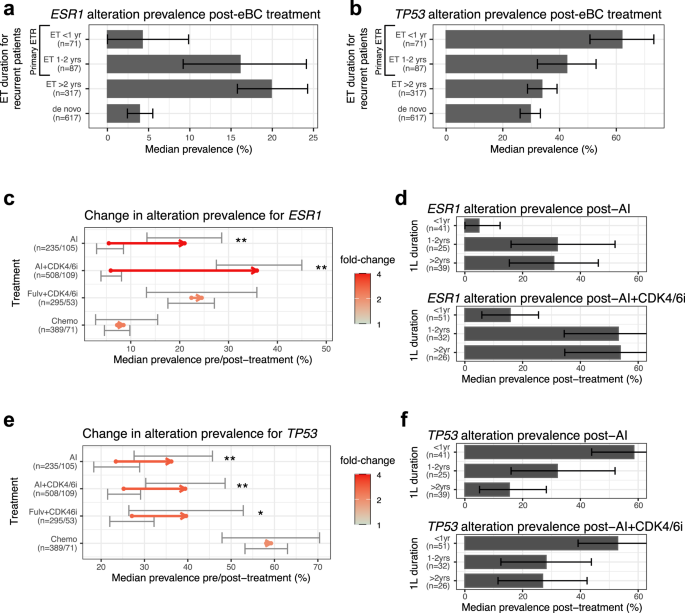
Começamos caracterizando a paisagem genômica de tumores de pacientes com resistência endócrina usando dados de CGP de amostras coletadas após o tratamento adjuvante e antes do início dos tratamentos de 1L. Descobrimos que a prevalência de alteração da ESR1 foi significativamente maior em tumores de pacientes com ETR secundária (19,9% [IC: 15,6, 24,7]) em comparação com aqueles de pacientes com ETR primária (10,7% [IC: 6,3–15,8], p < 10 − 4 ) (Figura 1a suplementar ). Em contraste, as alterações de TP53 foram significativamente mais prevalentes em amostras primárias de ETR (51,3% [IC: 43,7–58,9]) em comparação com amostras secundárias de ETR (33,8% [CI: 28,4–39,1], p <10 −4 , Figura 1b Complementar ). Outros genes apresentaram diferenças menores entre os dois grupos de pacientes com ETR (Figura 1c Complementar ). Ao avaliar as mudanças na prevalência com base na duração do tratamento endócrino adjuvante (TE) antes da recaída, descobrimos que o perfil genômico dos tumores mudou em torno de um ponto de corte de 1 ano. A prevalência de alteração para tumores expostos a 1–2 anos de TE foi de 16,1% (IC: 9,2–24,1) para VHS1 (Fig. 2a ) e 42,5% (IC: 32,2–52,9) para TP53 (Fig. 2b ) - valores que são mais próximo da prevalência encontrada em amostras de ETR secundária do que em amostras expostas a menos de 1 ano de TE adjuvante (4,2% [IC: 0,0–9,9] e 62,0% [CI: 50,7–73,2], respectivamente). Outros genes mostraram maior separação ao usar 1 ano como ponto de corte para a duração do TE adjuvante antes da recaída (Figura 1d Complementar ). Em comparação com a prevalência de alterações encontradas em amostras de pacientes com doença metastática de novo (3,9% [IC: 2,4–5,5] para VHS1 e 29,7% [IC: 26,1–33,2] para TP53 ), tumores de pacientes com recidiva dentro de 1 ano em O TE adjuvante foi caracterizado por uma prevalência substancialmente maior de alterações no TP53 , enquanto os tumores de outros pacientes recorrentes (> 1 ano em TE adjuvante) tiveram maior prevalência de alterações no ESR1 (19,1% [IC: 15,3–22,8]).
a , b Prevalência de alterações ESR1 ( a ) e TP53 ( b ) em amostras coletadas de pacientes antes da divisão de 1L pela duração do eBC ET (tratamento endócrino) antes da recaída. As barras de erro representam o intervalo de confiança de 95% com base na inicialização. c Prevalência de alterações na VHS1 antes ou após o tratamento com 1L no cenário avançado em diferentes coortes. A seta representa a diferença de prevalência: sua origem é a prevalência mediana pré-tratamento e seu final é a prevalência mediana pós-tratamento. As barras de erro representam o intervalo de confiança de 95% da prevalência; A cor representa a magnitude da mudança de dobramento; * significa p < 0,05, ** para p < 0,01 com base em bootstrapping; As coortes de tratamento são rotuladas no eixo y . d Prevalência de alterações na VHS1 após tratamento de 1L estratificada pela duração do tratamento de 1L antes da coleta da amostra. As barras de erro representam o intervalo de confiança de 95% da prevalência. e Prevalência de alterações no TP53 antes ou após o tratamento com 1L no cenário avançado em diferentes coortes. Mesma legenda de c . f Prevalência de alterações no TP53 após tratamento de 1L estratificada pela duração do tratamento de 1L antes da coleta da amostra. Mesma legenda de d .
A prevalência de alteração da ESR1 pós-IA+CDK4/6i é maior que pós-IA
Em seguida, estudamos a interação entre os tratamentos de 1L e os perfis genômicos do tumor, comparando a prevalência de alteração em amostras colhidas antes de 1L com aquelas colhidas após a exposição de 1L (Fig. 1d , ver Métodos). Como esperado, observamos um aumento nas alterações do ESR1 após tratamentos baseados em IA. Em comparação com outros estudos 8 , 9 , 10 , 16 , 17 , 19 , dividimos os pacientes com base na exposição a CDK4/6i, o que identificou uma diferença significativa (Fig. 2c ): a prevalência de alterações de ESR1 aumentou substancialmente mais em amostras de pacientes tratados com IA+CDK4/6i (35,8% [IC: 27,5-45,0]; p < 10 −4 ) em comparação com aqueles tratados apenas com IA (21,0% [CI: 13,3–28,6], p < 10 −4 ), resultando na diferença de 1,71 vezes (IC: 1,11–2,81, p = 0,0066) pós-tratamento. A prevalência nos grupos de pré-tratamento foi semelhante em 5,5% (IC: 3,0–8,5) e 5,9% (IC: 3,9–8,1) para as coortes AI e AI+CDK4/6i, respectivamente. Em contraste, a coorte de pacientes tratados com fulvestrant+CDK4/6i apresentou um aumento mínimo de 22,4% (IC: 17,6–27,1) pré-tratamento para 24,5% (IC: 13,2–35,8) pós-tratamento ( p = 0,38). A maior prevalência de alteração da VHS1 pré-tratamento nesta coorte pode ser explicada por uma maior proporção de pacientes com doença recorrente em comparação com outras coortes de 1L (Tabela 1 ). O aumento não significativo na prevalência de alteração da VHS1 pós-tratamento foi consistente com o estudo PALOMA-3 43 . A coorte de quimioterapia também não mostrou diferença na prevalência de alterações de VHS1 entre os grupos pré e pós-tratamento ( p = 0,38). Para a grande maioria dos pacientes, uma única variante subclonal foi detectada no tumor e a distribuição de frequências alélicas cumulativas não foi substancialmente diferente entre grupos e coortes de tratamento (Figura 2a suplementar ), com mais de 75% das mutações ocorrendo em códons L536, Y537 ou D538.
Para validar a diferença na prevalência de alteração de ESR1 pós-tratamento com base na exposição a CDK4 / 6i, realizamos análises estratificadas (Fig. 1d , ver Métodos). Primeiro, descobrimos que a diferença não estava associada à duração do tratamento de 1L. As alterações de ESR1 foram sistematicamente mais prevalentes na coorte AI + CDK4 / 6i ao dividir o pós-grupo pela duração do tratamento de 1L antes da coleta da amostra (Fig. 2d ). Em segundo lugar, descobrimos que alterações de ESR1 estavam presentes em amostras de pacientes de novo e recorrentes após tratamento com 1L (Figura 2b Complementar ). Deve-se notar que alterações no ESR1 também foram encontradas em alguns tumores amostrados de pacientes com doença metastática de novo antes de 1L. Como esses pacientes podem ter sido classificados erroneamente como de novo devido a uma lacuna na sua história clínica, não podemos concluir que alterações na ESR1 possam estar presentes antes do tratamento. Terceiro, não houve diferenças substanciais entre pacientes com doença visceral versus aqueles sem ( p > 0,21). Por último, descobrimos que a prevalência de alterações de ESR1 em amostras da localização primária foi semelhante à prevalência em amostras metastáticas ( p > 0, 26; Figura 2c Complementar ). Além disso, as mutações ESR1 ativadoras de Y537 e D538 ocorreram em amostras da localização primária tão frequentemente quanto em amostras metastáticas após AI + CDK4 / 6i (Figura 2d Complementar ). Esses resultados sugerem que as lesões no sítio primário podem abrigar mutações oncogênicas no ESR1 após o tratamento com 1L, abordando uma discussão em andamento sobre o local das mutações no ESR1 8 , 15 , 16 , 18 , 19 , 44 , 45 . Para consolidar a análise estratificada entre os grupos pós-tratamento, realizamos um modelo de regressão logística multivariada da ocorrência de VHS1 em todas as coortes de tratamento com base em variáveis clínicas. Identificamos “coleta de amostras após exposição a IA e AI+CDK4/6i” como a única variável significativa. Quando realizamos uma análise semelhante comparando diretamente as coortes pós-IA vs. pós-AI + CDK4/6i, identificamos “duração de 1L ao longo de 1 ano” ( p < 1,6 × 10 −5 ) e “exposição a CDK4/6i” (contraste contra “somente exposição à IA”, p = 5,4 × 10 −4) como as duas variáveis clínicas significativas (coeficientes positivos), enquanto o efeito de interação de “duração de 1L e exposição a CDK4/6i” não foi significativo (ver Métodos). Esses resultados confirmaram que tanto a “duração de 1L ao longo de 1 ano” como a “exposição a CDK4/6i” contribuem independentemente para uma maior prevalência de alterações na VHS1 após tratamento de 1L.
A alteração do TP53 está associada à menor duração de 1L
Além da ESR1 , descobrimos que a prevalência de alteração do TP53 também foi significativamente maior após 1L (Fig. 2e ): de 23,4% (IC: 18,3–28,9) pré-tratamento para 36,2% (IC: 27,6-45,7) pós-tratamento no IA coorte ( p = 0,086); de 25,2% (IC: 21,5–29,1) para 39,4% (IC: 30,3–48,6) na coorte AI+CDK4/6i ( p = 0,002); e de 27,1% (IC: 22,0–31,2) para 39,6% (IC: 26,4–52,8) na coorte Fulv+CDK4/6i ( p = 0,040). Permaneceu inalterado na coorte de quimioterapia. A prevalência de alterações no TP53 foi associada à duração do tratamento de 1L em ambas as coortes baseadas em IA, de forma semelhante aos resultados no cenário adjuvante (Fig. 2f ). Foi mais elevado em amostras colhidas no primeiro ano de 1L (> 50%) e caiu para ~30% para amostras colhidas mais de 1 ano após o início de 1L, o que estava próximo da prevalência pré-1L. Em seguida, realizamos um modelo de regressão logística multivariada semelhante, conforme explicado acima, para entender os fatores clínicos que levaram à ocorrência de alteração do TP53 nas coortes baseadas em IA. Ao comparar as coortes pós-IA vs. AI+CDK4/6i, identificamos “duração de 1L ao longo de 1 ano” ( p = 0,003) como a única variável clínica significativa (coeficiente negativo), enquanto “exposição a CDK4/6i”, bem como a O efeito de interação de “duração de 1L e exposição a CDK4/6i” não foi significativo (ver Métodos). Estes resultados foram consistentes com um enriquecimento de alterações de TP53 em tumores de progressão rápida 40 devido à resistência intrínseca ou rapidamente adquirida, em contraste com alterações de ESR1 que são mais prováveis de serem adquiridas sob tratamento num momento posterior. Esta observação pós-1L foi consistente com o resultado na configuração adjuvante (Fig. 2d, f ).
Múltiplos genes têm prevalência de alteração significativamente maior após AI+CDK4/6i
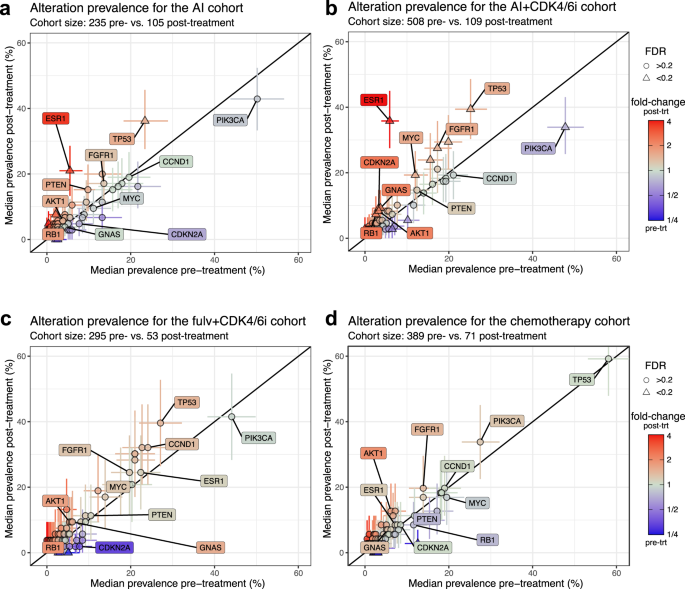
Em seguida, avaliamos sistematicamente as mudanças na paisagem genômica do tumor com base nos genes do painel CGP (Fig. 3a-d ). Especificamente na coorte AI + CDK4 / 6i, identificamos genes adicionais com prevalência de alteração significativamente maior pós-tratamento (Fig. 3b ). Alterações de ativação do FGFR1 foram encontradas em 27,5% (IC: 19,3-35,8) das amostras pós-tratamento em comparação com 17,3% (CI: 14,2-20,7) pré-tratamento (FDR = 0,17), refletindo um papel potencial na resistência ao CDK4/6i 25 , 46 , 47 , 48 . O RB1 apresentou um aumento de 2,31 vezes (IC: 1,0-4,61, FDR = 0,17) para 7,3% (CI: 2,8-12,8) pós-tratamento, consistente com o impacto conhecido da perda de Rb na sensibilidade do CDK4/6i 9 , 24 , 26 , 49 . Uma tendência semelhante estava presente na coorte Fulv+CDK4/6i (1,78 vezes [IC: 0,29–4,56], FDR = 0,35), mas com menor prevalência pós-tratamento (5,7%, [IC: 0,0–13,2]). A prevalência de alterações de AKT1 aumentou 2,09 vezes (IC: 0,98–3,92, FDR = 0,17) na coorte AI+CDK4/6i, conforme observado anteriormente 4 . A mesma tendência foi observada nas outras coortes, mas não foi significativa, potencialmente devido ao baixo número de pacientes com alterações de AKT1 . Outros genes com diferença significativa na coorte AI+CDK4/6i incluíram MYC (de 12,0% [IC: 9,3–15,0] a 19,3% [CI: 11,9–26,6], FDR = 0,17), GNAS (de 3,7% [CI: 2,2–5,5] a 9,2% [IC: 4,6-14,7], FDR = 0,17) e CDKN2A (de 3,3% [IC: 1,8–4,9] a 9,2% [CI: 4,6–14,7], FDR = 0,17). Nenhum desses genes apresentou prevalência de alteração significativamente maior pós-IA ou pós-quimioterapia, e a prevalência pós-tratamento foi maior na coorte AI+CDK4/6i, reforçando o impacto específico e profundo do CDK4/6i na paisagem genômica do tumor.
a – d Prevalência mediana de alterações antes (eixo x) ou após (eixo y) tratamento para terapias AI ( b ) terapias AI+CDK4/6i ( c ) terapias fulvestrant + CDK4/6i, ou quimioterapias d . Cada ponto é um gene individual; genes de interesse são rotulados. As barras de erro representam o intervalo de confiança de 95%; A cor reflete a mudança de dobra; Significância da forma com um ponto de corte FDR de 0,2 com base no bootstrapping e no procedimento de Benjamini-Hochberg.
exclusividade de alterações após terapias de 1L destaca múltiplas vias oncogênicas
Utilizando o DISCOVER 50 , avaliamos a exclusividade mútua de genes comumente alterados e descobrimos que as alterações ESR1 e TP53 são fortemente exclusivas no grupo pós-IA ( p = 0,0086), conforme relatado anteriormente 8 , 16 , 43 , 51 , mas menos após IA Tratamento +CDK4/6i ( p = 0,044; Figura 3a suplementar ). Além disso, observamos que as alterações do FGFR1 foram significativamente exclusivas das alterações do PIK3CA ( p = 0,0046 para pós-AI + CDK4/6i) e, mais geralmente, de outros genes da via PI3K/AKT ( PTEN e AKT1 ) 3 , 16 , 19 também como GNAS (Figura 3b suplementar , p = 0,037 para o conjunto de genes pós-AI + CDK4 / 6i). Nossos dados identificaram dois grupos adicionais de genes em sua maioria exclusivos: CDKN2A / RB1 / CCND1 (Figura 3c Complementar ) e NF1 / MAP3K1 / MAP2K4 (Figura 3d Complementar ). Com base nesses resultados, definimos cinco conjuntos de genes para realizar análises em nível de via: via FGFR1/PI3K, ciclo celular e via MAPK, bem como ESR1 e TP53 como genes individuais. No grupo pós-IA, as alterações da ESR1 foram exclusivas das alterações da via MAPK, conforme descrito anteriormente ( p = 0,003, teste exato de Fisher) 19 , 52 , mas não na coorte pós-AI+CDK4/6i ( p = 0,62, Figura Suplementar). 4a, b ) . Além disso, as alterações de ESR1 em amostras pós-AI + CDK4/6i tenderam a ocorrer simultaneamente com alterações em pelo menos um outro conjunto de genes ( p = 0, 092, Figura 4b suplementar ) em contraste com as amostras pós-IA nas quais alterações de ESR1 são exclusivos de alterações em outras vias ( p = 0,032).
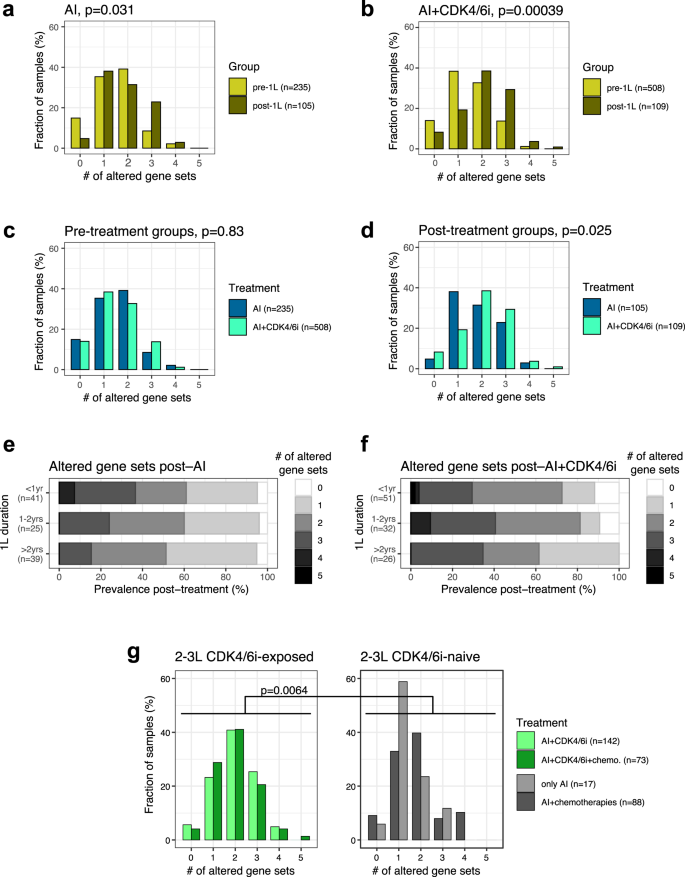
Com base nas alterações nos genes incluídos nos cinco conjuntos de genes definidos acima, avaliamos o número de conjuntos com genes alterados em amostras individuais. Encontramos um aumento significativo no número de conjuntos de genes alterados concomitantes após tratamentos com IA e AI + CDK4/6i ( p = 0, 031 e, respectivamente, p = 3, 9 × 10 −4 , teste unilateral de Kolmogoroff-Smirnoff, Fig. 4a, b ). Este aumento foi menos pronunciado nas coortes Fulv + CDK4/6i ( p = 0,13) ou quimioterapia ( p = 0,097) (Figura 4c, d suplementar ). O número de conjuntos de genes alterados concomitantes para as coortes baseadas em IA foi distribuído de forma semelhante pré-1L ( p = 0,83, Fig. 4c ), mas aumentou para valores significativamente mais elevados nas amostras pós-AI + CDK4/6i em comparação com pós-AI uns ( p = 0,025, Fig. 4d ). De facto, 72,5% das amostras tratadas com CDK4/6i tinham dois ou mais conjuntos de genes alterados versus apenas 57,1% das amostras tratadas com IA. Essa diferença foi sistemática em diferentes durações de 1L, com um pico de 33, 9% das amostras colhidas entre 1 e 2 anos de tratamento com AI + CDK4 / 6i apresentando alterações em pelo menos 3 conjuntos de genes (Fig. 4e, f ). Portanto, alterações concomitantes em múltiplas vias oncogênicas foram mais comuns em amostras de tumores após exposição a CDK4/6i em comparação com amostras sem exposição a CDK4/6i.
a – d Distribuição do número de conjuntos de genes alterados para grupos de pré e pós-tratamento das coortes ( a ) AI, ou b AI+CDK4/6i, bem como para ( c ) pré-tratamento e d pós- grupos de tratamento de coortes baseadas em IA. Valores de P baseados no teste de Kolmogorff-Smirnov. e , f Distribuição do número de conjuntos de genes alterados para as amostras pós-tratamento das coortes ( e ) AI e f AI+CDK4/6i com base na duração do tratamento de 1L antes da coleta da amostra. g Distribuição do número de conjuntos de genes alterados de amostras coletadas após 2L ou 3L com base nas coortes de tratamento. Valor de P entre amostras expostas a CDK4/6i (esquerda) ou não (direita) com base no teste de Kolmogorff-Smirnov.
A paisagem genômica dos tumores após o tratamento 2L confirma os resultados de 1L
Em seguida, nos concentramos em amostras de tumores de pacientes expostos a múltiplas linhas de terapia em ambiente avançado. A prevalência de alterações de ESR1 em amostras coletadas após 2L confirmou a associação com a exposição a CDK4/6i que observamos após 1L: para pacientes tratados com IA ou IA+quimioterapia, a prevalência de alteração de ESR1 foi em torno de 15-30%, enquanto coortes de pacientes expostos a IA + CDK4/6i teve uma prevalência em torno de 30-40% (Figura 5a Complementar ). Deve-se notar que a carga mutacional tumoral (TMB) foi baixa e semelhante em amostras de todas as coortes (Figura 5b suplementar ). Além disso, nestas coortes, a prevalência de mutações ESR1 em amostras da localização primária permaneceu comparável àquela das amostras do local metastático (Figura 5c Complementar ). Além disso, o número de conjuntos de genes alterados concomitantes permaneceu maior em amostras expostas a AI + CDK4 / 6i em comparação com aquelas expostas apenas a quimioterapias AI ou AI + após o tratamento de 2-3L ( p = 0,0064, Fig. 4g ).
Dados de ensaios clínicos confirmam o impacto do CDK4/6i no cenário genômico do tumor
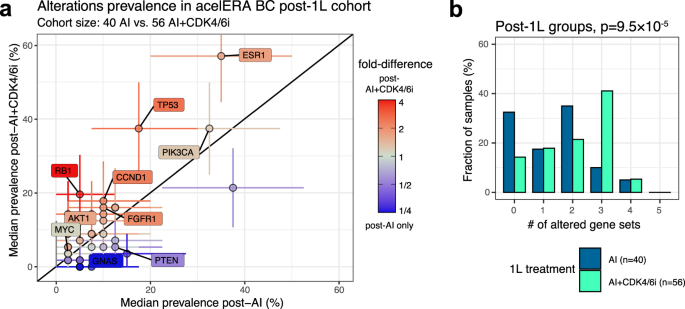
Para validar os resultados obtidos do RWD, aproveitamos os dados de CGP baseados em biópsia líquida (LB) coletados no início do estudo para um ensaio clínico recente, acelERA BC (NCT04576455) que inscreveu 2L/3L pacientes com ER+/HER2- BC localmente avançado ou mBC 41 . Deve-se notar que o ensaio CGP baseado em LB tem uma sensibilidade diferente do ensaio CGP para tumores sólidos e pode potencialmente identificar alterações de lesões múltiplas. Devido a esta diferença, limitamos a análise a comparações dentro dos dados do ensaio acelERA BC. Entre os pacientes 2L, 40 receberam terapia com IA como 1L, enquanto 56 tiveram AI+CDK4/6i como 1L. Amostras de pacientes da coorte AI+CDK4/6i apresentaram VHS1 significativamente maior (diferença de vezes de 1,64 [IC: 1,05-2,85], p = 0,016) e prevalência de alteração de TP53 (diferença de vezes de 2,14 [IC: 1,09-5,95] , p = 0,013) em comparação com amostras da coorte somente de IA (Fig. 5a ). Alterações do ciclo celular ( principalmente RB1 ) e conjuntos de genes MAPK também foram mais prevalentes em amostras da coorte AI+CDK4/6i. O número total de conjuntos de genes alterados, conforme definido acima, também foi significativamente maior ( p = 9,5 × 10 −5 , Fig. 5b ). Em particular, 67% das amostras pós-IA+CDK4/6i tinham pelo menos dois conjuntos de genes alterados em comparação com 50% da coorte pós-IA. Quando expandimos nossas coortes para incluir pacientes pós-2L e aqueles expostos a quimioterapias ( N = 80 pacientes tratados com um regime AI+CDK4/6i em 1L ou 2L; N = 75 pacientes não expostos a CDK4/6i), os resultados foram qualitativamente semelhante com ESR1 e RB1 sendo significativamente maior pós-CDK4/6i (Figura 6 Complementar ). Assim, os dados dos ensaios clínicos confirmaram o impacto do CDK4/6i no perfil genômico dos tumores HR+/HER2- que observamos na RWD.
a Prevalência mediana de alterações em amostras de pacientes pós-1L que receberam IA (eixo x) ou AI+CDK4/6i (eixo y) como tratamento 1L. Cada ponto é um gene individual; genes de interesse são rotulados. As barras de erro representam o intervalo de confiança de 95%; A cor reflete a mudança de dobra; Significância da forma com um ponto de corte FDR de 0,2 com base no bootstrapping e no procedimento de Benjamini-Hochberg. b Distribuição do número de conjuntos de genes alterados para as amostras de pacientes pós-1L que receberam IA ou AI+CDK4/6i como tratamento de 1L. Valores de P baseados no teste de Kolmogorff-Smirnov.
Discussão
A aprovação do CDK4/6i mudou drasticamente o cenário terapêutico do mBC HR+/HER2-, e ensaios clínicos recentes no cenário adjuvante estão moldando ainda mais o atendimento ao paciente 53 . A próxima classe de medicamentos que pode mudar a prática são os SERDs orais, cujos benefícios terapêuticos em relação à IA e ao fulvestrant podem ser mais fortes para pacientes avançados com tumores com mutação ESR1 33 , 34 , 41 , 54 . Para desenvolver e utilizar essas terapias de forma ideal, tornou-se fundamental compreender como a exposição ao CDK4/6i altera o panorama genómico dos tumores metastáticos, em particular no que diz respeito às mutações associadas aos resultados do tratamento, como TP53 e ESR1 . Nossos resultados baseados em RWD, e validados usando dados de ensaios clínicos, oferecem cinco conclusões para essa questão. Primeiro, a exclusividade entre as mutações TP53 e ESR1 reflete-se na duração dos tratamentos adjuvante e 1L. Em ambos os cenários, os pacientes cujo tumor progrediu dentro de 1 ano com TE são mais propensos a abrigar mutações no TP53 , enquanto os tumores resistentes tratados com> 1 ano de TE são enriquecidos em alterações de ESR1 . As diferenças entre a prevalência de alterações de TP53 e ESR1 são provavelmente devidas a uma progressão mais precoce de tumores com alterações prévias de TP53 , enquanto as mutações de ESR1 têm maior probabilidade de serem adquiridas em tumores que respondem inicialmente ao tratamento. Em segundo lugar, a prevalência de alterações na ESR1 é significativamente maior após a exposição à IA+CDK4/6i em comparação com a IA isoladamente. Este resultado foi consistente em análises estratificadas, incluindo a duração do tratamento de 1L, e validado em dados de ensaios clínicos. Terceiro, além do ESR1 , outros genes são alterados com mais frequência após a exposição ao AI+CDK4/6i em comparação com o AI sozinho. O FGFR1 foi de interesse devido a relatórios anteriores sobre o seu papel na resistência ao CDK4/6i 25 , 46 , 47 , 48 . Sua exclusividade com alterações da via PI3K/AKT sugeriu redundância funcional na superação de AI+CDK4/6i 27 , 29 , 50 , 55 . O GNAS é menos conhecido, mas pode ser significativo dada a sua associação com mau prognóstico 37 e exclusividade com outros genes na via PI3K/AKT. O aumento nas alterações de RB1 apoia ainda mais o papel da perda de função de RB1 na progressão em CDK4/6i 9 , 26 , 56. Deve-se notar que o ensaio CGP aproveitado aqui captura apenas alterações genômicas e não alterações na expressão gênica. Isto pode ser relevante para CCNE1 e CDK6 , cuja regulação positiva tem sido associada à progressão de CDK4/6i em BC 28 , 56 . Quarto, os tumores pós-AI+CDK4/6i apresentaram ocorrência concomitante de alterações em múltiplas vias oncogênicas. Em particular, é mais provável que alterações de ESR1 e TP53 ocorram com alterações em genes de outras vias (ciclo celular, PI3K/AKT ou MAPK) em tumores expostos a CDK4/6i em comparação com aqueles expostos apenas a IA. Finalmente, os efeitos da exposição a CDK4/6i ainda são observados em amostras de linhagens posteriores, sugerindo que o tratamento com CDK4/6i pode ter um efeito duradouro no perfil genômico do tumor HR+/HER2-.
Como o nosso trabalho se baseou em RWD recolhidos retrospectivamente, identificámos e abordámos várias advertências devido à natureza dos dados e às perguntas que fizemos neste trabalho. Primeiro, nosso estudo não é baseado em amostras pareadas, que é o padrão ouro para estudar mecanismos de resistência. Nosso método, baseado na comparação de coortes definidas pela data de coleta da amostra em relação ao tratamento, visa enfrentar esse desafio intrínseco ao uso secundário de dados (neste caso RWD) não coletados propositalmente para estudar mecanismos de resistência. Embora não identifiquem explicitamente os mecanismos de resistência, nossos resultados nos permitiram descrever a evolução do cenário genômico dos tumores dos pacientes em todas as linhas de terapias. Em segundo lugar, a integridade dos dados da prática clínica de rotina pode variar, o que pode enfraquecer o sinal para comparações baseadas na história clínica do paciente. Por exemplo, tratamentos adjuvantes anteriores para alguns pacientes metastáticos podem não ser relatados na base de dados e esses pacientes podem ter sido classificados erroneamente como de novo. Esta ressalva é compensada pelo maior número de pacientes em nosso conjunto de dados, o que nos permitiu identificar sinais significativos na RWD. Por último, os grupos de comparação podem ser tendenciosos, o que pode levar a resultados falsos positivos. Por exemplo, as amostras utilizadas para CGP eram mais provavelmente provenientes da localização primária no grupo de pré-tratamento, enquanto o grupo de pós-tratamento continha mais amostras de locais metastáticos. Nossa abordagem para resolver esse problema foi realizar análises estratificadas com base em possíveis fatores de confusão, construir modelos multivariados para identificar contribuintes significativos para o sinal observado e inicializar nossos resultados e corrigir vários testes para avaliar a significância. Nossos resultados não mostraram diferenças qualitativas com base em variáveis clínicas e foram robustos através de múltiplas atualizações do corte de dados. Nossas análises estratificadas e interpretação conservadora dos resultados foram projetadas para excluir potenciais confundidores do sinal observado na coorte geral e, assim, evitar resultados falsos positivos. Descobrimos, portanto, que os desafios no estudo dos mecanismos de resistência de RWD coletados retrospectivamente podem ser abordados pela abordagem rigorosa que propusemos e, assim, permitir alavancar uma população de pacientes mais ampla e maior do que aquela tradicionalmente encontrada em dados de ensaios clínicos para identificar diferenças significativas na genômica do tumor. perfis.
Prevemos vários resultados translacionais de nossas descobertas. Primeiro, nossos resultados identificaram que a duração do tratamento com IA está associada a um perfil genômico diferente: tumores de pacientes com recidiva entre 1 e 2 anos de tratamento adjuvante com TE (atualmente classificados como ETR primário) têm um perfil genômico mais semelhante ao perfil dos tumores de pacientes com ETR secundária do que aqueles com recidiva dentro de 1 ano. No cenário avançado, os perfis tumorais também diferem com base em um ponto de corte de 1 ano para duração de 1L. Assim, a estratificação dos pacientes pela duração das terapias adjuvantes e 1L pode permitir a seleção de tumores com diferentes biologias. Em segundo lugar, o aumento na prevalência da mutação ESR1 após a exposição a CDK4/6i tornará o papel dos SERDs orais importante na inibição da atividade mutante de ESR1 , uma vez que os regimes baseados em CDK4/6i se tornaram o padrão de tratamento no cenário metastático. Terceiro, após a progressão no CDK4/6i, é provável que múltiplas vias oncogênicas sofram mutação no mesmo tumor, enfatizando a necessidade de novas terapias que possam ser combinadas com SERDs orais e inibidores do ciclo celular com toxicidade tolerável. Paralelamente aos inibidores da via PI3K/AKT e outras terapias direcionadas a mutações na via MAPK ou amplificação do FGFR1 , o desenvolvimento de terapias conjugadas anticorpo-fármaco pode atender a esta necessidade 57 . Finalmente, o desenvolvimento de novas terapias para pacientes com HR+/HER2-BC avançado terá que levar em conta um panorama genômico que poderá evoluir ainda mais com a aprovação do CDK4/6i no cenário adjuvante 53 , 58 .
Em conclusão, a análise da RWD ligada ao perfil genómico abrangente pode revelar diferenças na paisagem genómica do tumor associada aos regimes de tratamento. Bootstrapping, análise estratificada e comparação com dados de ensaios clínicos reforçaram nossa confiança nesses resultados e, assim, nos permitiram identificar que a exposição a CDK4/6i levou a um cenário genômico diferente – mais alterado – de tumores HR+/HER2-BC. Este resultado e a associação da prevalência de alteração do ESR1 com o tempo de tratamento podem informar o desenho de ensaios clínicos no cenário metastático e podem ajudar a orientar a estratégia de tratamento para pacientes avançados. Além das implicações para o atendimento ao paciente e o desenvolvimento de medicamentos, nosso trabalho demonstra a viabilidade de aproveitar dados clínico-genômicos do mundo real para pesquisa translacional em oncologia e a identificação de estratégias de tratamento mais personalizadas.
Métodos
Critérios de inclusão da coorte
O banco de dados FH é um banco de dados longitudinal retrospectivo de âmbito nacional, com sede nos EUA, que compreende dados estruturados e não estruturados em nível de paciente desidentificados, curados por meio de abstração habilitada por tecnologia 36 , 42 . O CGDB do FH-FMI é um banco de dados desidentificado que liga os dados desidentificados do EHR da população de FH aos dados genômicos derivados dos testes CGP do FMI por correspondência determinística e desidentificada 36 . Os pacientes foram incluídos na coorte de câncer de mama (BC) do FH-FMI CGDB se: (1) tivessem pelo menos duas consultas clínicas documentadas na Rede FH, em dias diferentes, ocorridas em ou após 1º de janeiro de 2011; (2) eles foram diagnosticados com CM (com base na Nona Revisão da Classificação Internacional de Doenças - Modificação Clínica [CID-9 - CM] códigos: CID-9 174.x [neoplasia maligna da mama] ou 175.x [maligna neoplasia de mama masculina], ou Décima Revisão da Classificação Internacional de Doenças - Modificação Clínica [CID-10 - CM] código: CID-10 C50x [neoplasia maligna de mama]); (3) foram submetidos ao teste CGP por meio de um teste FMI em uma amostra com histologia confirmada pelo patologista que era consistente com CM; (4) eles foram submetidos a testes CGP com data de relatório e data de coleta de amostra não antes de 30 dias antes, em ou a qualquer momento após a data do diagnóstico inicial de CM confirmada pelo prontuário FH (se a data de coleta de amostra não estava disponível, apenas a data do relatório do FMI tinha que atender a esse critério; se a data do diagnóstico inicial não estivesse disponível, foi usada a data mais antiga da recorrência loco-regional do paciente ou do diagnóstico de CM metastático); (5) suas informações demográficas estavam disponíveis na FH e seu relatório de testes da FMI foi correspondido de forma única e determinística por um fornecedor terceirizado de vinculação; e (6) o diagnóstico de CM confirmado pelo prontuário de HF foi feito em ou após 1º de janeiro de 2011. Os dados clínicos dos pacientes e os dados genômicos de amostras de biópsia desses pacientes foram coletados conforme descrito anteriormente 36 , 42 , 59 .
O grupo do subtipo BC foi determinado com base na imuno-histoquímica e nos resultados do teste de hibridização fluorescente in situ do receptor de estrogênio, receptor de progesterona e status de HER2, conforme documentado no EHR. Os pacientes foram considerados portadores de doença HR-positiva se seus tumores fossem positivos para receptores de estrogênio e/ou receptores de progesterona. Os pacientes foram considerados portadores de doença HER2 positiva se seus tumores fossem registrados como hibridização fluorescente in situ positiva/amplificada, imunohistoquímica positiva (3+) ou NOS positiva. Para o status HR/HER2, um paciente foi considerado positivo para um biomarcador se o status de um determinado biomarcador dentro da janela de 90 dias antes ou depois do diagnóstico de mBC fosse positivo. Se não estivessem disponíveis dentro de uma janela de 90 dias, os dados do teste eBC foram usados em substituição aos dados do teste mBC para determinar o status do biomarcador. Aplicamos a seguinte hierarquia à avaliação do biomarcador do subtipo BC: positivo > negativo > duvidoso > desconhecido. O subtipo HR-positivo, HER2-negativo, foi definido como pacientes com status de HR como positivo e status de HER2 como negativo ou equívoco.
Genotipagem tumoral
Alterações genômicas foram identificadas via CGP de >300 genes relacionados ao câncer no teste de sequenciamento de próxima geração (NGS) da FMI (FoundationOne®CDx, FoundationOne®) 36 , 42 , 59 , ambos baseados em biópsia de tumor sólido. A classificação em amostras de locais primários versus locais metastáticos é baseada no local do corpo de onde o material tumoral analisado foi extraído. Para a maioria das amostras de tecido sólido, as informações de texto livre fornecidas no campo Local da amostra no formulário de requisição de teste podem ser mapeadas para um vocabulário controlado. Os dados dos testes de CGP líquido foram insuficientes em número de pacientes para apresentar resultados significativos do CGDB. Para o estudo acelERA BC, 229 pacientes (de 303 inscritos) tinham dados disponíveis do CGP realizado no início do estudo usando o teste ctDNA da FMI (FoundationOne® Liquid CDx), que é baseado em biópsia líquida.
Alterações (variação no número de cópias, mutações pontuais e rearranjos) foram categorizadas como patogênicas conhecidas, provavelmente patogênicas ou variantes de significado desconhecido. Para este trabalho consideramos como 'alteradas' apenas as alterações patogênicas conhecidas e prováveis, independentemente de sua natureza. Os polimorfismos de nucleotídeo único da linha germinativa foram ignorados em nossa análise. A carga mutacional tumoral (TMB), uma medida do número de mutações somáticas identificadas por megabase de DNA sequenciado, foi calculada para a maioria das amostras 60 .
Análise estatística das diferenças na prevalência de alterações
Após definir coortes com base no tratamento, estimamos para cada gene as mudanças na prevalência de alterações entre grupos pré-tratamento e pós-tratamento ou entre coortes. Este estimador é semelhante à razão de risco das proporções, que chamamos de razão de mudança de dobra para refletir o desenho onde o cálculo é entre grupos pré/pós da mesma coorte de tratamento e interpretado como mudança de pré para pós-tratamento potencialmente devido à interação de tratamento, ou como razão de diferença de vezes para refletir o desenho quando o cálculo é sobre grupos de diferentes coortes de tratamento. Para estimar essa razão, bem como a prevalência de alterações nos grupos (proporções), utilizamos métodos bootstrap não paramétricos. Também calculamos os intervalos de confiança percentuais com alfa = 0,05 , bem como um valor p empírico para a hipótese nula de que razão de mudança de dobra = 1 . Os testes estatísticos foram bilaterais. Ao realizar uma análise sistemática de todos os genes no CGP, os valores de p assim calculados são então corrigidos para testes múltiplos usando o procedimento de Benjamini-Hochberg para todos os genes testados no painel com uma prevalência de alteração acima de 2% (seja pré ou pós -grupo) para uma determinada comparação (consulte arquivos de dados suplementares). Consideramos valores de p inferiores a 0,05 como estatisticamente significativos e um FDR de 0,2 como um ponto de corte aceitável, dada a natureza exploratória desses experimentos, bem como o uso posterior na tomada de decisões. Embora os aumentos fortes e significativos na prevalência tenham maior probabilidade de estar relacionados com o tratamento, vale a pena notar que a interpretação do aumento ou diminuição marginal da prevalência pós-tratamento pode ser ambígua, mesmo que significativa, devido ao viés de seleção dos pacientes.
Análise estratificada e regressão logística para avaliar potenciais fatores de confusão
Conforme explicado acima, nossa métrica primária de associação de alterações genômicas com o tratamento é a razão bruta de mudança ou diferença de dobra calculada ao longo de uma coorte completa. Para avaliar os efeitos de potenciais confundidores desta associação, realizamos análise estratificada definindo estratos com base nas características do paciente e nas propriedades da amostra (Fig. 1d ). Consideramos os seguintes potenciais confundidores de prevalência de alteração: duração de 1L antes da coleta da amostra pós-tratamento, doença de novo vs. recorrente, localização da amostra (primária vs. metastática), presença ou ausência de metástases viscerais e raça do paciente. Nossa abordagem foi comparar qualitativamente a métrica por estratificação em subcoortes, controlando cada potencial confundidor de prevalência de alteração, um de cada vez. Se a métrica bruta de mudança de dobra for semelhante às métricas específicas do estrato, a associação do tratamento com alterações genômicas é robusta à seleção de pacientes e a fatores de confusão.
Para confirmar nossos achados, realizamos regressão logística para identificar os fatores clínicos que impulsionam a prevalência da alteração. Para as comparações de grupos pré-pós, regredimos nos potenciais confundidores listados acima e em uma variável binária adicional para o grupo amostral (pré ou pós-tratamento). Se a variável temporal da amostra for a única variável significativa, confirma que nenhum dos fatores de confusão entre os grupos pré-pós explica a diferença na prevalência de alteração. Para outras comparações de coortes, regredimos em potenciais fatores de confusão e uma variável adicional que capturou a diferença em coortes (por exemplo, “tratamento para IA” vs. “comparação AI+CDK4/6i”) e termos de interação onde era relevante (por exemplo, “regime de tratamento e duração do tratamento de 1L”).
- Gerar link
- X
- Outros aplicativos


Comentários
Postar um comentário